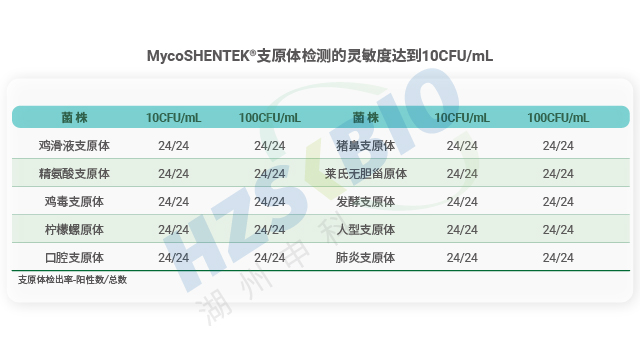
MycoSHENTEK® 支原体 qPCR 检测试剂盒(2G)完全符合 EP 2.6.7 的全部验证要求,其检测灵敏度、特异性、耐用性均按药典标准完成完整性能验证,具备替代培养法和指示细胞培养法的合规资质。该试剂盒针对新型生物制品的检测痛点优化升级,经多种支原体菌株验证,灵敏度稳定达到 10 CFU/mL,满足法规对替代培养法的要求。同时,产品遵循 ISO13485 体系认证和 GMP-like 生产标准,可提供完整的验证报告、质检报告及菌株溯源文件,全程贴合各国药典监管要求,为企业合规检测提供坚实支撑。
支原体标准菌株对支原体检测试剂盒的选择、使用及验证至关重要。安徽复杂基质支原体检测验证菌株
可比性验证是支原体检测 NAT 方法替代传统检测方法的关键依据,法规明确要求需将 NAT 法与药典规定的传统方法进行检测限(LOD)对比。若以 NAT 法替代培养法,需证实其检测限≤10CFU/mL;替代指示细胞培养法时,每种被测支原体的检测限需≤100CFU/mL。对比实验需采用相同样本同步开展 NAT 检测与传统方法检测,通过 CFU 可比性分析,确保两种方法的检测结果具有一致性。这一要求既保障了新方法的检测效能不低于传统标准,又为生物制品企业切换检测方法提供了合规依据,兼顾了效率提升与质量安全。
江西复杂基质支原体检测使用性验证rHCDpurify 前处理系统可自动化提取支原体 DNA,减少人为误差提升批间稳定性。
湖州申科围绕 USP 支原体培养法,提供技术服务,满足生物制剂企业的合规需求。服务内容包括两项:一是支原体培养法样品检测服务,严格遵循 USP 63 标准流程执行,确保检测结果合规有效;二是支原体培养法样品适用性验证服务,针对供试品特性开展定制化验证,保障检测方法与样品的适配性。所有检测与验证完成后,公司将出具标准化报告,报告可直接用于项目申报、审批、工艺优化等场景,为企业产品质量控制提供依据。通过专业的技术服务,帮助企业规避合规风险,确保生物制剂生产全流程的质量与安全性,助力企业高效推进产品研发与上市进程。
检测限验证是支原体 NAT 方法(核酸扩增法)合规性的关键要求,法规明确界定需为每种目标支原体确定阳性检测临界值。验证流程需满足严格的实验设计:每种支原体至少进行三次单独的 10 倍梯度稀释,每次稀释后需制备平行管检测,再确保各稀释浓度获得 24 个检测结果。阳性临界值的判定标准为,该浓度下至少 95% 的试验运行能得到阳性结果,即 24 个样品中需至少出现 23 个有效阳性结果。这一严谨设计旨在确保 NAT 检测方法在实际应用中,能够稳定检出低浓度支原体污染,避免因检测灵敏度不足导致的安全风险,为生物制品质量控制提供可靠保障。
支原体污染来源多样,包括人源、动物源及环境,需多方位监测。
培养基的科学选择与合规使用是支原体培养法检测成功的基础,湖州申科按 USP 标准明确了三类推荐培养基的适用场景。Hayflick Media 用于支原体一般性检测,Frey Media 专门针对滑液囊支原体检测,Friis Media 则适用于非禽类支原体检测。为确保少量支原体(约 100cfu 或 100ccu)不被遗漏,需使用足够数量的固体与液体培养基开展检测;若选用其他替代培养基,必须严格符合 USP 标准要求。此外,每批培养基均需进行针对性的微生物检测(即营养特性测试),通过标准化的质量把控,避免因培养基性能缺陷导致检测失效,为后续检测流程提供稳定可靠的基础条件。
CAR-T 产品支原体检测需在放行前快速完成,湖州申科快速版试剂盒 2.5 小时可出结果。浙江细胞疗法产品支原体检测快速检测
支原体检测过程中,需严格遵循 “先阴后阳” 操作原则,避免交叉污染。安徽复杂基质支原体检测验证菌株
支原体 NAT 检测中异常曲线的出现多与操作设置、耗材使用或实验环境相关,需针对性排查解决。首先需确认软件设置正确性,对照试剂盒说明书检查时间、温度、循环数、荧光采集等参数,尤其需注意关闭不含 ROX 试剂的参比荧光功能。其次若扩增曲线无抬升却出现 CT 值,需调整基线范围,将起点设为荧光信号稳定的循环数,终点设为扩增曲线起峰前一个循环数。再者需确保耗材与仪器匹配,避免使用普通 PCR 耗材或与加热模块规格不符的反应管,防止荧光传导不佳或热传导不充分。此外,曲线先上升后下降可能是反应液蒸发导致,上机前需检查八连管管盖无缝隙,避免液面下降干扰结果。
安徽复杂基质支原体检测验证菌株