湖州申科建立了标准化的低内毒素回收(LER)技术服务流程,全周期支撑内毒素检测优化:7 个自然日内完成客户沟通与 LER 确认,用天然鲎、重组鲎等方法检测并出具报告;60 个自然日开展方法开发,分析 LER 成因(如螯合剂、蛋白质 IP)并研究去掩蔽方案;30 个自然日进行 HTS 验证,完成 3 批 LER 实验与干扰实验,交付稳定试剂盒、操作规程及培训;再协助方法转移与 cGMP 验证。流程每环节均围绕内毒素检测展开,确保企业高效解决 LER 问题,满足法规要求。
在医药、生物制品及医疗器械等诸多领域,细菌内毒素检测是保障产品质量与安全的关键环节。浙江生物制品内毒素检测
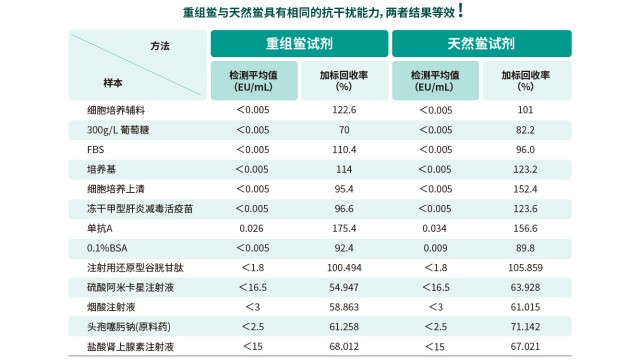
湖州申科生物重组级联试剂(rCR)采用基因工程技术合成,完全模拟了天然鲎试剂中的酶促级联放大反应。重组鲎试剂反应体系中包含重组C因子、重组B因子和重组凝固酶原。当供试品中存在内毒素,重组C因子识别内毒素后活化,会依次级联活化下游重组B因子和重组凝固酶原。凝固酶原转化为具有生物活性的凝固酶后,识别并催化下游带显色基团的底物产生显色反应。显色反应的强度和内毒素浓度成正相关,从而定量检测内毒素。本产品用于定量测定人用和动物用注射药物、生物制品及医疗器械等样品中的细菌内毒素的含量。
化学制药内毒素检测细菌内毒素检查用水需符合灭菌注射用水标准,内毒素含量有明确限值且无干扰。
样品中存在的非特异性鲎反应启动物,会绕过内毒素直接触发鲎试剂反应,导致内毒素检测出现假阳性,需针对性消除干扰。常见的非特异性启动物包括 1,3-β-D 葡聚糖和含丝氨酸蛋白酶的生物制品(如胰酶):1,3-β-D 葡聚糖会启动鲎试剂的 G 因子旁路,不依赖内毒素即可引发凝胶形成或光度变化;胰酶等丝氨酸蛋白酶类物质,其作用机制与内毒素触发鲎试剂的过程相似,会模拟内毒素信号导致误判。针对这类干扰,若样品含 1,3-β-D 葡聚糖,可使用试剂盒配套的抗增液,通过抑制 G 因子活性阻断旁路启动;若样品为胰酶等生物制品,可通过加热处理(如 80℃加热 10 分钟)灭活丝氨酸蛋白酶,避免其模拟内毒素反应。这些处理措施能有效排除非特异性信号,确保内毒素检测只针对目标内毒素产生响应,提升结果准确性。
低内毒素回收(LER)与传统鲎试剂干扰(抑制 / 增强)在多维度存在差异,准确区分对优化内毒素检测至关重要。表现上,LER 是内毒素回收率<50%,传统干扰是反应抑制或增强;成因上,LER 由螯合剂 + 表面活性剂协同或蛋白质电荷结合引发,传统干扰因 pH、β- 葡聚糖等导致;排除方式上,LER 时间依赖且无法稀释解决,传统干扰浓度依赖且可通过稀释缓解;确认方法上,LER 需通过保存时间研究(HTS),传统干扰按药典干扰实验评估。明确这些区别能帮助企业排查内毒素检测异常,避免误将 LER 当作普通干扰处理。
样本含内毒素结合物时,可尝试用分散剂减少抑制,保障内毒素正常检出。
内毒素检测方法易受样品基质干扰,法规要求在方法应用前必须进行干扰验证,选择标准曲线中点或一个靠近中点的内毒素浓度,作为供试品干扰试验种添加的内毒素浓度计算回收率,若回收率在 50%-200% 范围内,表明无明显干扰;若回收率异常,需通过过滤、中和、透析、加热处理等方式优化样品前处理。方法学确认还需涵盖线性范围(如 0.005-5 EU/mL)、精密度(批内 CV≤15%)、检测限(LOD≤0.01 EU/mL)等指标,确保方法在实际样品检测中稳定可靠,符合《美国药典》 <85>、《中国药典》通则 1143 等药典要求。
内毒素检测需关注制剂成分,螯合剂和表面活性剂可能诱发“低内毒素回收(LER)”。浙江抗体药物内毒素检测抗干扰方案
表面活性剂会改变内毒素活性,用重组级联试剂检测前需稀释样本,消除其对反应的干扰。浙江生物制品内毒素检测
随着动物保护理念和法规要求升级,重组因子C法(rFC法)作为 LAL 法的替代技术逐渐普及。重组 C 因子是以基因重组的方式表达的 LAL 试剂中的 C 因子,C 因子被内毒素活化后切割荧光底物产生游离荧光基团,通过检测荧光信号可以反应活化后的蛋白酶活性,并由此可以推算出内毒素的含量。与传统 LAL 法相比,rFC 法无需依赖鲎血资源,避免了天然 LAL 试剂批间差异大、易受 β- 葡聚糖干扰等问题,且反应特异性更强。目前,《美国药典》、《欧洲药典》等法规已收录 rFC 法,欧盟更推荐其用于疫苗等高风险产品检测,在保证检测准确性的同时,符合动物福利和可持续发展要求。
浙江生物制品内毒素检测