菌株质量是支原体检测 NAT 方法验证合规的关键,GC/CFU 比(基因组拷贝数与菌落形成单位比值)是关键控制指标。支原体存在聚集特性,单一 CFU 可能对应多个菌体,且 DNA 复制与细胞分裂不同步,部分菌体无法形成菌落但会释放 DNA,导致 GC/CFU 比波动大(研究报道 0.1 CFU 对应 30-500 个基因组拷贝)。若使用高 GC/CFU 比菌株,会高估检测限、导致方法灵敏度不足,因此法规明确要求菌株 GC/CFU 比<10。2024 年 EDQM 36.1 草案规定参考品 GC/CFU 比应小于 10,USP 77 征求意见稿要求表征菌株 GC/CFU 比、建立菌株库 CFU 与核酸拷贝数关系,JP G3-14-170 也对菌株质量提出明确要求,凸显合规菌株选择的重要性。
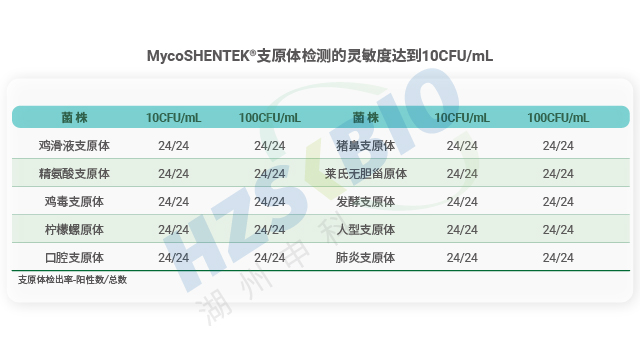
支原体检测中,检测限验证需对每种支原体做3次10倍梯度稀释,获取24个数据满足95%检出率。四川重组药物支原体检测可比性验证
湖州申科的支原体验证菌株以高稳定性与合规性为重点优势,满足 NAT 方法验证需求。菌株来源可靠,均取自国内外合规机构验证菌株标准盘,溯源至美国 ATCC(口腔、肺炎支原体)、中国 CVCC(猪鼻支原体)等正规保藏机构,获正式商用授权,标定浓度涵盖 10CFU 与 100CFU。生产环境合规,在 BSL-2 生物安全实验室开展,符合国家生物安全法标准,针对不同菌株特性逐个优化生产工艺,涵盖超 10 种菌株的主代与工作代。质控环节严谨,采用高灵敏度培养基(液体、固体、半流体),保障菌落易观察分离与 CFU 计数准确性;冻存前后均通过固体平皿培养法测定 CFU,联合合规机构建立数字 PCR 标定方法,经实验室间对比验证,准确监控 GC/CFU 比,确保菌株质量达标。
河南干细胞产品支原体检测核酸扩增法欧洲药典(EP)2.6.7 认可 NAT 法作为支原体检测替代方法,需通过检测限与可比性验证。
长期以来,支原体检测主要依赖培养法和指示细胞法,且法规通常要求两种方法同时使用,但这两类方法存在明显短板——培养法检测周期长达 28 天,指示细胞法也需较长时间等待结果。随着细胞疗法药物快速发展,其上市周期短、货架期有限的特点,使得传统方法难以满足药物放行的时效要求。核酸扩增技术(NAT)尤其是荧光探针 qPCR 检测方法的出现,凭借检测速度快、特异性强的优势,成为支原体检测的理想替代方案。作为替代方法,NAT 检测需通过严格验证以达到法规要求的灵敏度:检测限达到 10CFU/mL 可替代培养法,达到 100CFU/mL 可替代指示细胞培养法,从而实现快速且可靠的支原体筛查。
支原体 NAT 检测的样本结果需结合 FAM 信号与 VIC 信号的表现综合判定,同时警惕抑制现象对结果的影响。若 FAM 信号 2 复孔有 1 孔以上 Ct<40 且呈有效 “S” 型扩增,VIC 信号 2 复孔 Ct<40 且呈有效 “S” 型扩增,判定为阳性;若 VIC 信号 2 复孔 Ct≥40 或无明显扩增曲线,则为阳性但存在抑制。若 FAM 信号 2 复孔 Ct≥40 或无明显扩增曲线,VIC 信号 2 复孔 Ct<40 且呈有效 “S” 型扩增,判定为阴性;若 VIC 信号同样 Ct≥40 或无明显扩增曲线,则阴阳性无法判断且存在抑制。出现抑制现象需重测,重测仍有抑制时,阳性倾向样本可适当稀释,阴性倾向样本需优化提取条件。
支原体标准菌株在生物制药与生物检测行业中承担着关键角色,其重要性将随着生物制品的发展而愈发凸显。
支原体检测培养法是生物制剂质量控制的关键环节,湖州申科提供的 USP 支原体培养法检测服务,严格遵循USP<63 mycoplasma tests(culture method)>标准,为生物制剂开发与生产提供可靠保障。该方法适用于检测组织或细胞培养物、消化肉液及其他疑似支原体污染的材料,是确保生物技术产品及生产用材料合规性的必要要求。检测周期约 29 天,流程需满足双重要求:每批次培养基必须进行营养特性测试,确保检测效能;供试品需完成抑制物质检测,若生产方法发生变化可能影响检测结果,需重复该测试,避免抑制成分干扰支原体检出,保障检测结果的准确性与可靠性。
支原体兼具胞内胞外生存特性,检测需裂解细胞而非只取上清,避免漏检胞内污染。四川重组药物支原体检测可比性验证
湖州申科支原体验证菌株溯源至 ATCC/CVCC,标定 10CFU/100CFU,满足验证需求。四川重组药物支原体检测可比性验证
支原体 NAT 检测中异常曲线的出现多与操作设置、耗材使用或实验环境相关,需针对性排查解决。首先需确认软件设置正确性,对照试剂盒说明书检查时间、温度、循环数、荧光采集等参数,尤其需注意关闭不含 ROX 试剂的参比荧光功能。其次若扩增曲线无抬升却出现 CT 值,需调整基线范围,将起点设为荧光信号稳定的循环数,终点设为扩增曲线起峰前一个循环数。再者需确保耗材与仪器匹配,避免使用普通 PCR 耗材或与加热模块规格不符的反应管,防止荧光传导不佳或热传导不充分。此外,曲线先上升后下降可能是反应液蒸发导致,上机前需检查八连管管盖无缝隙,避免液面下降干扰结果。
四川重组药物支原体检测可比性验证